Des isotopes sont des atomes dont les noyaux ont le même nombre[...]
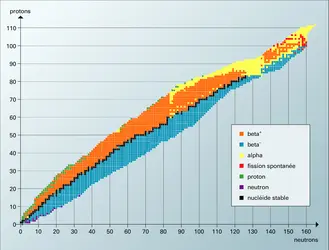
La carte des nucléides
Découverts en 1913 par le chimiste britannique Frederick Soddy, leur nom, qui vient du grec iso (« même ») et topos (« lieu »), signifie qu’ ils occupent la « même place » dans le tableau de classification périodique de Mendeleïev. Pour les représenter, on remplace ce tableau par la « carte des nucléides[...]
Des propriétés nucléaires très différentes
Des atomes isotopes ont le même cortège électronique et, par conséquent, des propriétés chimiques identiques. En revanche, les propriétés physiques varient un peu d’un isotope à un autre, car les masses atomiques différentes modifient diverses quantités, comme les densités ou les températures d’ébullition.
Mais ce sont[...]
De l’hydrogène à l’uranium
L’élément le plus simple, l’ hydrogène, est présent de façon stable sous la forme de 2 isotopes : l’isotope habituel 1H est constitué d’un unique électron en orbite autour d’un proton ; en revanche, le deutérium D (ou 2H, parfois appelé hydrogène lourd) a un noyau contenant un neutron en plus du proton. Le tritium T (ou 3H) est un isotope instable dont le noyau contient 2 neutrons. Il est produit dans les installations nucléaires et lors des explosions atomiques ; il se transforme spontanément en hélium[...]
Applications industrielles
La mise au point des armes nucléaires, puis les besoins de l’industrie, et en particulier des centrales électronucléaires, ont nécessité l’élaboration de procédés de séparation isotopique. Le terme « séparation » est cependant abusif, car ces procédés modifient les rapports des différents isotopes présents dans un échantillon sans vraiment les séparer.
On parle aussi d’« enrichissement » d’un mélange en un isotope[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter